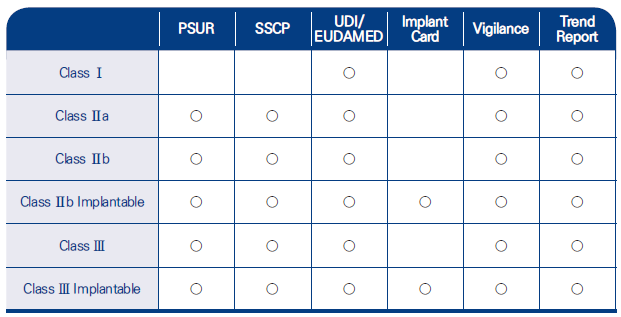
1. Vigilance – 심각한 사고 및 현장 안전성 시정조치 보고
임상용 기기가 아닌 기기를 유럽 연합 시장에 이용 할수 있게 한 기기의 제조사는 제 97조 2절에 따라 다음사항을 관련 보건 당국에 보고 해야 합니다. (a) 제품 정보에 명확히 기록되고 기술문서에 정량화되며 제88조에 따라 경향보고의 대상이 되는 예상 부작용을 제외하고, 유럽연합 시장에 이용 할수 있게 된 기기를 포함하는 모든 심각한 사고, (b) 현장 안전 시정조치에 대한 이유가 제 3국에 이용할 수 있게된 기기로 한정되지 않는 경우, 유럽 연합 시장에도 법적으로 이용할 수 있게 된 기기에 관련하여 제3국에서 수행된 모든 현장 안전 시정조치를 포함하여, 유럽 연합 시장에 사용 가능한 기기에 관련된 모든 현장 안전 시정조치 보고서는 제92조에 언급된 시판 후 감시에 관한 전자시스템을 통해 제출 해야 합니다.
2. 경향보고서 (Trend Report)
제조사는 제92조에 따른 감시 및 시판 후 감시에 관한 전자시스템으로 부속서 I의 1 및 5절에 규정된 이익-위험 분석에 중대한 영향을 미칠 수 있으며 의도된 이익에 대해 비교될 때 허용될수 없는 환자, 사용자 또는 다른 사람들의 건강 또는 안전에 대한 위험성을 초래했거나 예상할수 있는 심각하지 않은 사고 또는 예상되는 바람직하지 않은 부작용인 사고의 주기 또는 심각성에서 무엇이든 통계적으로 상당한 증가성이 있는지를 확인하고 보고하여야 합니다. 제조사는 사고를 어떻게 관리할 것인지 그리고 제 84조에 언급된 시판 후 감시 계획의 관찰 기간뿐만 아니라 그러한 사고의 주기 또는 심각성에서 무엇이든 통계적으로 상당한 증가를 판단하기 위해 사용된 방법론을 규정해야 합니다.
3. 제조자의 의무사항
MDR Articl 10(9)는 제조사가 기기 위험등급과 기기유형에 비례해 품질경영시스템을 수립, 문서화 실행해야 하며 기기의 전체 수명 주기 동안 그 유효성을 유지해야 한다고 규정하고 있습니다. 주요 내용으로는 다음과 같습니다. 첫번째, (a) strategy for regulatory compliance, including compliance with conformity assessment procedures and procedures for management of modifications to the devices covered by the system (적합성 평가 절차에 따른 규제준수 전략), (b) identification of applicable general safety and performance requirements and exploration of options to address those requirements (각 제품에 적용되는 부속서 I. GSPR의 식별 및 요건 충족을 위한 방안 조사해야 합니다.), (c)reponsibility of the management(QMS의 실행, 유지 및 지속적 개선을 보장하는 경영진의 책임이 있어야 합니다., (d)resurce management including suppliers and sub-contractors(공급자 및 계약자의 선택 및 관리를 포함한 자원관리 프로세스), (e)부속서 I의 제 3절에 규정한 위험관리프로세스), (f)PMCF를 포함하여 제61조와 부속서 XIV에 따른 임상평가, (g)제품실현 프로세스, 제품계획, 설계, 개발, 생산 및 서비스 제공에 이르기까지 확장, (h)(UDI 할당의 검증, 제공된 정보의 일관성 및 유효성을 보장하기 위한 절차), (i)시판후 감시(PMS)시스템의 수립, 실행 및 유지, (j)관계 당국, 인증기관, 경제 운영자와의 의사소통 관리, (k)Vigilance 시스템 절차- 심각한 사고와 현장 안정 시정 조치의 보고를 위한 프로세스), (i)시정 및 예방 조치의 관리와 그 유효성의 검증, (m)제품성능 및 개선 필요성과 관련된 데이터를 측정하고 조치하는 프로세스(MDR 요건 & EN ISO13485:2016/A11:2021 Annex ZA 참조 두번째, 시판후 감시 시스템을 실행하고 최신으로 유지 해야합니다. 세번째, Shall immediately inform the competent authirites a serious risk. 네번째, Shall have a system for recording and reporting of incidents and field safety corrective actions, 다섯번째, 시정조치를 위한 관계당국의 모든 요청에 협조해야 합니다. 만약 제조사가 협조하지 않은 경우, 기기를 그 시장으로부터 철수 또는 회수하기 위한 모든 적절한 조치를 할 수 있습니다, 여섯번째, 제조사는 기기의 위험등급, 기기의 유형, 그리고 기업의 규모에 비례하는 방식으로 , 잠재적 책임에 대해 충분한 재정적 보상범위를 제공해야 합니다. 일곱번째, 제조사는 기술문서 EU자가 적합선언서 인증서의 사본을 마지막 기기가 출시된 후 최소 10년 의 기간동안, 이식형 기기는 최소 15년동안 사용할수 있도록 보장 해야합니다. 여덟번째, Labelling과 허가 문서가 일치해야 합니다. 아홉번째, 1등급을 포함한 모든 제품에 대해 임상평가를 요구 합니다. 열번째, 10. Class III and Implantable devices will require clinical investigation - 예외) this will not be required for the class III and Implantable products that are certified according to 93/42/EEC currently : sufficient clinical data (충분한 임상data 기반으로임상평가가 이루어진 경우) : in compliance with the relevant product-specific CS (CS 준수)